
细胞产业国家工程中心:以科技创新引领现代化产业体系建设
2023年12月28日
鼓励“高端化、智能化制药设备”!国家发改委发布《产业结构调整指导目录(2024年本)》,2月1日实施
2024年1月10日赛动ELN引领合规前沿,赋能新药IND电子安全性报告提交

随着全球医药监管环境的持续演进,研究性新药(IND)申请的提交方式正步入全新时代。美国食品药品监督管理局(FDA)于 3 月 28 日定稿了“以电子形式进行监管提交:IND 安全性报告”的指南。指南规定自2026年4月1日起,所有IND安全性报告必须通过电子系统提交。

这一变革标志着纸质文档时代的终结,并对生物医药企业提出了更高的数据管理与信息化要求。在此背景下,赛动智造自主研发的ELN(可信记录本系统)凭借其前瞻性的设计理念与强大的功能特性,充分满足FDA的新规要求,成为助力医药企业顺利过渡并高效应对未来IND电子提交挑战的理想选择。
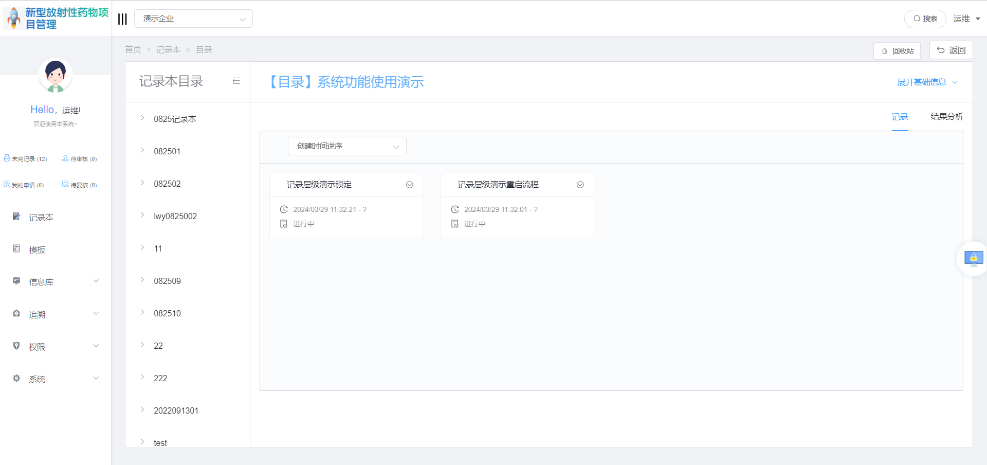
(图:ELN系统界面)
赛动智造ELN(可信记录本系统)设计核心紧密围绕数据完整性和合规性展开,确保生成的实验记录完全符合IND申报所需的高质量电子文档标准。系统内置的电子签名功能,不仅明确了操作主体的身份,确保数据的真实性和可靠性,而且通过不可篡改的特性,强化了对安全性数据完整性的保护,深度契合FDA对IND安全性报告电子提交的最新规定,与FDA对电子记录签名的严格要求精准匹配。
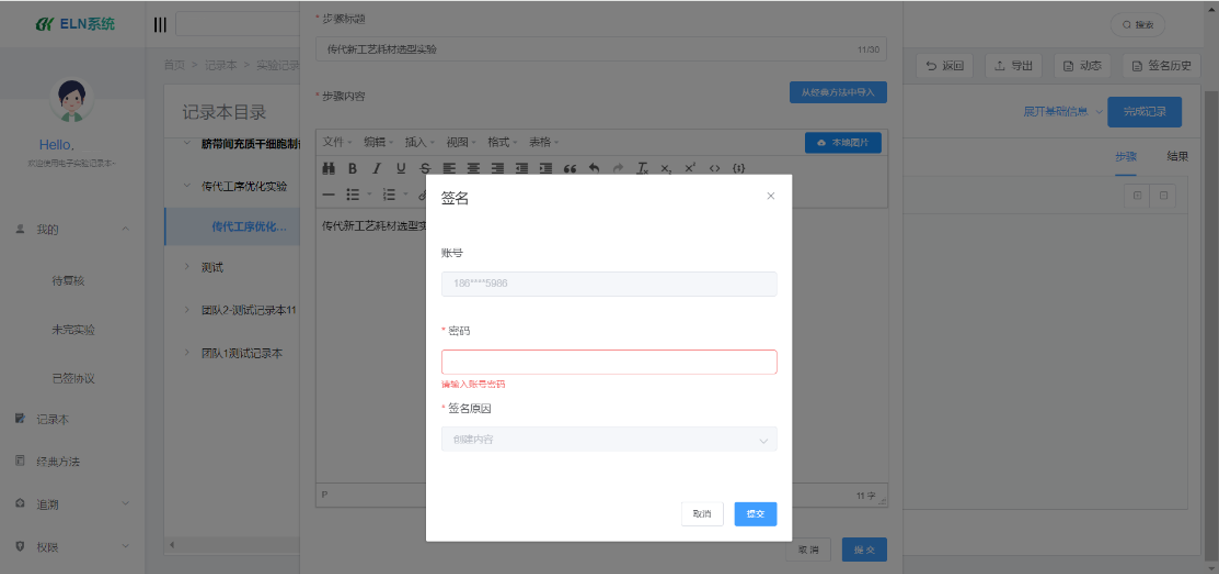
(图:电子签名场景)
面对IND申报材料日益复杂的结构化要求,赛动智造ELN(可信记录本系统)特别优化了对实验方案与实施、原始记录和总结报告的结构化管理能力。系统能够一键生成符合eCTD(电子通用技术文档)格式的申报材料,这一国际公认的文件编写格式不仅显著减少了企业在申报准备上的时间和经济成本,而且其标准化、模块化的特点极大地方便了药监机构的审评工作。赛动智造ELN的eCTD生成功能,使得医药企业能够在规定的截止日期前轻松完成IND安全性报告的电子化封装与提交,确保与FDA新规定无缝接轨。
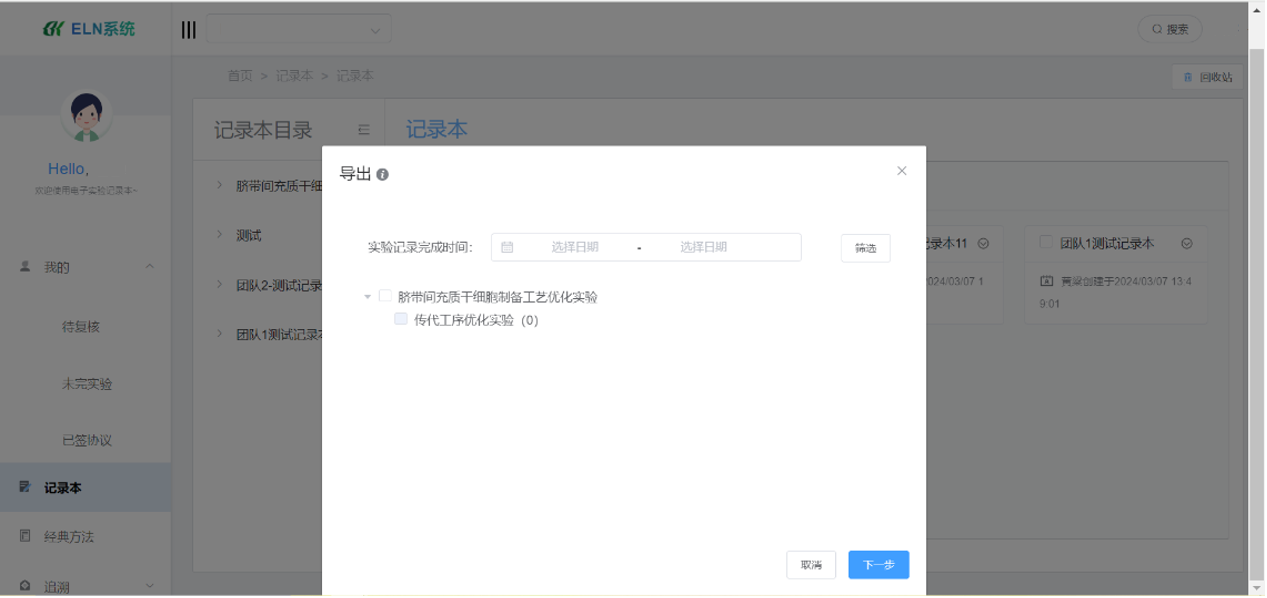
(图:报告导出场景)
在海量实验数据的采集与整合方面,赛动智造ELN(可信记录本系统)展现了卓越的智能化优势。系统支持自动获取各类仪器数据、智能识别语音与视频记录、图像识别以及处理化学结构、反应、光谱等专业数据类型,有效减轻研究人员的数据处理负担,确保安全性数据的准确无误。此外,赛动智造ELN的追溯审计功能确保所有实验操作均有迹可循,为IND安全性报告提供了详实、可追溯的证据链,增强了报告的科学性和可信度。
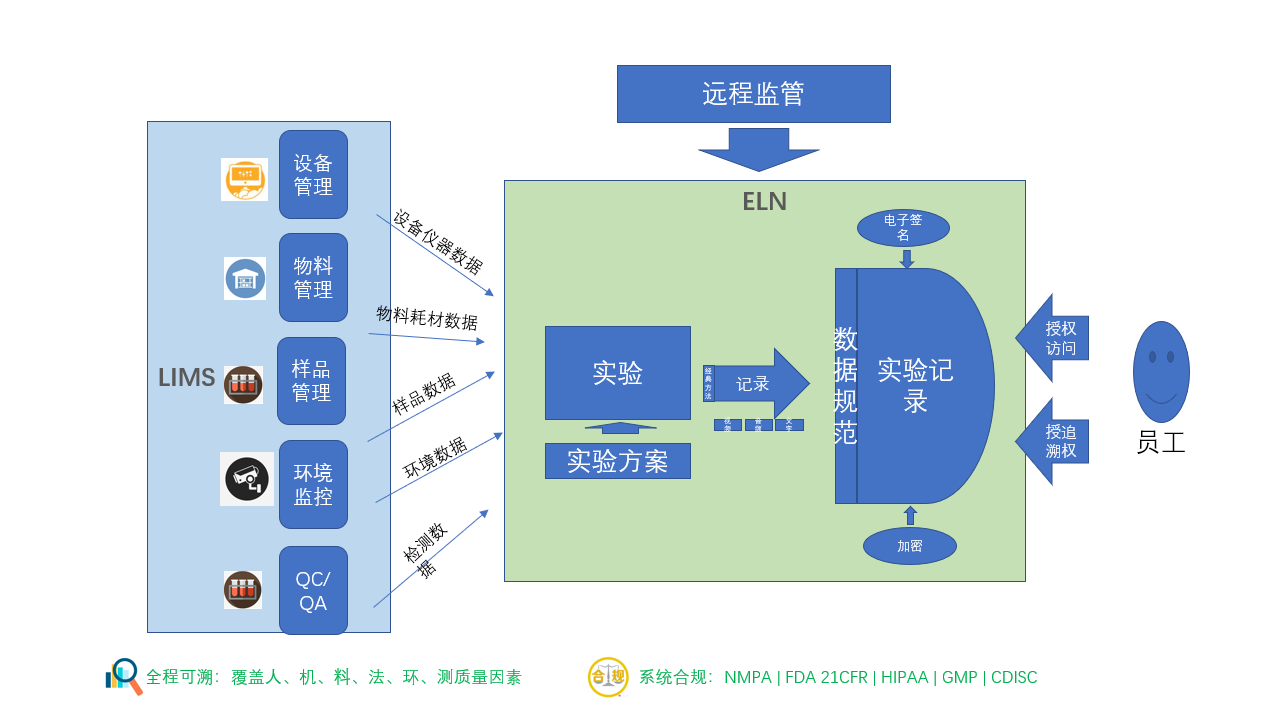
(图:数据集成及整合逻辑)
赛动智造ELN(可信记录本系统)遵循GAMP(良好自动化生产实践)指南,在设计、开发与验证过程中严格按照CSV(计算机化系统验证)要求,确保系统的生命周期合规性。从风险评估、用户需求定义到系统设计、验证与确认,每一个环节都严谨遵循法规标准,确保生成的IND安全性报告完全符合FDA对电子记录系统的合规性期待。这种全程合规的设计要求,不仅有助于企业在IND申报过程中规避潜在风险,也为未来可能面临的监管审计做好了充分准备。

(图:标准化项目管理)
除了直接服务于IND电子提交,赛动智造ELN(可信记录本系统)还以其人性化的设计和强大的功能,推动实验室日常管理的规范化与效率提升。系统支持多种记录模式以适应不同实验场景,同时通过智能辅助工具简化记录过程,使科研人员能够更加专注于实验本身,进而加速新药研发进程。对于管理者而言,ELN提供的实时监控、数据分析与报告功能,有助于实现对实验室活动的精细化管理,确保IND安全性数据的及时、准确生成与上报。
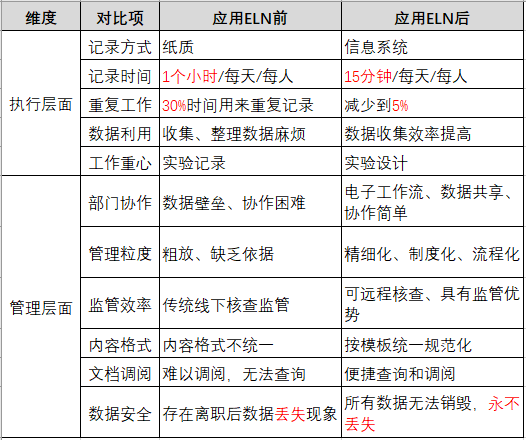
(表:客户使用ELN前后对比)
随着FDA等监管机构对“电子提交 IND”一系列指南的出台,赛动智造ELN(可信记录本系统)已成为医药企业在即将到来的法规变革中确保合规、提升效率、优化研发流程的重要工具。无论是从遵循ALCOA+CCEA原则的数据完整性维护、eCTD格式生成、智能化数据处理,还是全程合规设计与实验室管理优化,赛动ELN均展现出了卓越的适应性与前瞻性,为医药企业在激烈的全球竞争中赢得先机,顺利迈入IND电子提交的新纪元。

(图:客户现场使用ELN实景图)
截至目前,赛动智造ELN(可信记录本系统)已应用在细胞产业关键共性技术国家工程研究中心、深圳市非侵入性细胞质量在线监测和分析平台、哈尔滨国家级产业化项目“生物技术与信息技术融合应用工程”、放射性药物自动化产线研究与应用专项等重大国家项目,并获得了北科生物、科诺实验室、中安康华、未知君生物等用户的一致好评。
在致力于满足FDA关于IND电子安全性报告要求的同时,赛动智造更进一步,以全面的信息化、数字化解决方案助力生物医药企业遵循《细胞治疗产品生产质量管理指南》,确保细胞治疗产品研发与生产的全程合规与高效运营。除ELN之外,赛动公司基于药品全生命周期管理理念,还精心打造了WMS(物料管理系统)、LIMS(实验室信息管理系统)以及MES(生产管理系统)等,这些系统均具备电子记录、电子签名、追溯审计等功能,共同构建起覆盖药品全生命周期的数字化管理体系。
>>我们将陆续为大家介绍这些系统软件的详细内容,请持续关注!
赛动智造是我国最早实现细胞制剂数字化智能化产线研发量产的国家高新技术企业,在细胞自动化生产制备方面实现了关键技术突破,利用反向传播神经网络(BPNN)边缘计算识别分割细胞,应用数字孪生结合轻量深度学习追踪干细胞,实现全自动,智能控制干细胞产品生产,数字化追踪可视生产过程。承担2项国家级产业平台建设,1项深圳市生物医药产业重大公共服务平台建设。已在细胞智造关键技术领域布局系列专项,覆盖细胞制剂无人智造全流程。从生物治疗技术临床转化的早期布局者,到全国放射药领域的龙头企业,再到一流的现代化药包材生产企业,赛动智造均具备数字化、自动化、智能化产线的交付能力。
2022 年 4 月,国家发改委正式批复同意科诺实验室在深圳组建我国细胞产业领域唯一新序列国家工程中心——“细胞产业关键共性技术国家工程研究中心”(以下简称:细胞产业国家工程中心),将联合产业上下游,以有联系的科学和技术挑战模式,开展有明确应用导向的基础研究和工程创新活动,探索一种能将基础知识高效地转化为有用产品的组织形式。细胞产业国家工程中心提供跨越基础研究到产品开发、推广应用全流程的创新产业设施,成果转化支撑体系,创业服务平台等,聚集国际顶尖资源,提供创新创业产业空间,实现创新成果的首用示范。
